欢迎访问39肿瘤网!
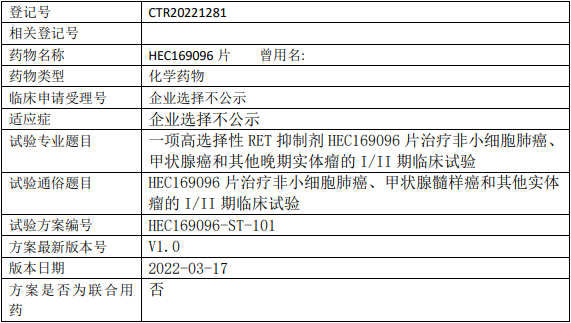
东阳光药业HEC169096临床试验,高选择性RET抑制剂HEC169096片治疗晚期实体瘤的I/II期临床试验
试验目的
I期主要目的
确定HEC169096的最大耐受剂量(MTD)/Ⅱ期推荐剂量(RP2D);
I期次要目的
1、评估HEC169096在晚期实体瘤受试者中安全性和耐受性;
2、观察HEC169096在晚期实体瘤受试者中的PK特征和药物代谢转化;
3、评估HEC169096在晚期实体瘤受试者中的疗效;
II期主要目的
评估HEC169096在RET融合NSCLC、RET突变MTC及其他RET改变晚期实体瘤受试者中的ORR;
II期次要目的
1、评估HEC169096在RET融合NSCLC、RET突变MTC及其他RET改变晚期实体瘤受试者中的其他抗肿瘤疗效指标(DCR、DOR、CNS ORR、CNS DOR、CBR、PFS,OS);
2、评估HEC169096在RET融合NSCLC、RET突变MTC及其他RET改变晚期实体瘤受试者中安全性和耐受性;
3、观察HEC169096在RET融合NSCLC、RET突变MTC及其他RET改变晚期实体瘤受试者中的PK特征和药物代谢转化。
试验设计
试验分类:安全性和有效性
试验分期:其它 其他说明:I/II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、签署知情同意书时,年龄≥18周岁,性别不限
2、组织病理学或细胞病理学确认的晚期实体瘤受试者
3、ECOG评分:0~2分
4、预期生存时间 ≥ 12周
5、按照实体瘤疗效评价标准(RECIST)V1.1,在I期试验,受试者至少存在一个可评估病灶;在II期试验,受试者至少存在一个可测量病灶。
6、必须有适当的器官功能
7、非哺乳期女性受试者;对有生育能力的女性受试者:筛选期血妊娠检查必须为妊娠阴性,且同意签署知情同意书至接受最后一剂试验药物后6个月内采取高效避孕措施。 未绝育的男性受试者:同意签署知情同意书至接受最后一剂试验药物品后6个月内采取高效避孕措施
8、受试者同意提供适当的肿瘤组织切片(可用的存档样本或新鲜活检样本制作的切片)
9、受试者自愿参加本研究,并由本人或监护人签署了书面知情同意书。
排除标准
1、存在明确的除RET以外的已知主要驱动基因改变。
2、符合以下任一情况的既往治疗史:
1)首次用药前6周内,接受过蒽环类、亚硝脲类、丝裂霉素类化疗;
2)首次用药前4周或5个药物半衰期(以时间者短者为准)之内,接受过其它化疗、小分子靶向治疗、免疫抗肿瘤治疗(免疫检查点抑制剂、CAR-T等)、大手术(主要脏器外科手术,不包括穿刺活检)治疗的受试者;
3)首次用药前2周内接受过姑息性放疗或者首次用药前4周内超过30%的骨髓放射或更广范围放疗者;
4)首次用药前1周内,接受过抗肿瘤中药(经NMPA批准有抗肿瘤适应症)治疗;
5)首次用药前4周内接种活疫苗(包括减毒活疫苗等)和/或计划入组后接种活疫苗者;
6)首次用药前4周或5个药物半衰期(以时间者短者为准)之内参加过任何干预性临床试验(参与总生存期随访受试者除外);
3、未从既往抗肿瘤治疗的不良反应中恢复至≤1级或者基线水平(依据CTCAE V5.0)
4、受试者患有中枢神经系统(CNS)转移或原发性CNS肿瘤,且表现有进行性神经系统症状或需要增加皮质类固醇剂量以控制其CNS疾病;脊髓压迫症、癌性脑膜炎或软脑膜症者;
5、首次用药前 5年内合并了其他恶性肿瘤。但不包括:转移或死亡风险可忽略不计(如预期5年OS > 90%)且经治疗后预期可治愈的肿瘤(如宫颈原位癌、皮肤基底细胞癌或鳞状细胞癌、接受根治性手术治疗的局限性前列腺癌、根治性手术治疗的乳腺导管原位癌等)或任何已治愈(5年内无疾病复发的证据)的其他肿瘤;
6、具有心脑血管风险因素
7、具有明确的出血倾向受试者,如消化道出血、出血性胃溃疡;给药前2个月内有黑便、呕血病史者;研究者认为可能发生内脏出血者;
8、无法控制的症状性甲状腺功能亢进或甲状腺功能减退;
9、现患临床活动性间质性肺病或活动性肺炎或现需治疗的放射性肺炎
10、患有先天或后天免疫功能缺陷(如HIV感染者);或者乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)活动感染者:筛选期HBsAg阳性或者HBcAb阳性的受试者,需要检测HBV DNA,HBV DNA定量≥104 cps/mL或≥2000 IU/mL;HCV抗体检测结果为阳性的受试者,需进一步检测HCV RNA,HCV RNA定量检测阳性;
11、存在临床上不可控制的胸腔积液/腹腔积液
12、在首次给药前2周内使用过CYP3A4强效抑制剂或强效诱导剂或者首次用药前1周内使用过质子泵抑制剂(PPIs);或者研究期间需要长期接受CYP3A4强效抑制剂或强效诱导剂或PPIs治疗的受试者
13、临床上明显的胃肠道异常,可能影响药物的摄入、转运或吸收(如无法吞咽、慢性腹泻、肠梗阻等),或全胃切除的受试者;
14、有精神类药物滥用史且无法戒除者或有精神障碍者;
15、研究者认为患有其它严重急性或慢性疾病、不适合参加临床试验者