欢迎访问39肿瘤网!
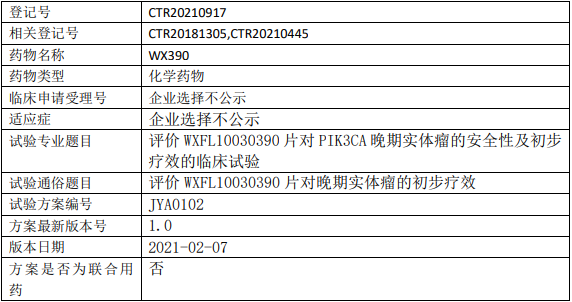
辰欣药业WX390临床试验,评价PI3K/mTOR双重抑制剂WX390(WXFL10030390片)治疗PIK3CA突变晚期实体瘤安全性及初步疗效的Ib/IIa期临床试验
试验目的
评价WX390治疗PIK3CA突变晚期恶性实体瘤的安全性及初步疗效。
试验设计
试验分类:安全性和有效性
试验分期:其他
设计类型:平行分组
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至 75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄18 ~ 75(含)周岁,性别不限;
2、组织学或细胞学确认的,经标准治疗失败、或无标准治疗方案、或现阶段不适用标准治疗的晚期恶性实体瘤(非小细胞肺癌除外)患者(结直肠癌患者必须提供基因检测结果证实为KRAS野生型);
3、存在PIK3CA突变(可接受荧光PCR法或NGS检测结果);
4、ECOG体力评分0-1 分;
5、根据 RECIST 1.1,至少有一个可测量的肿瘤病灶(位于既往辐照区域或经其他局部区域性治疗的部位的肿瘤病灶,如果出现明确进展或局部治疗 3 个月后持续存在,被认为是可测量病灶);
6、有足够的器官功能;空腹血糖<7mmol/L;HbA1C<8%;甘油三酯≤1.5×ULN;胆固醇≤1.5×ULN;
7、育龄期的女性患者在首次使用研究药物前前 7 天内的血或尿妊娠试验必须为阴性;
8、受试者须在试验前对本研究知情同意,并自愿签署书面的知情同意书;
排除标准
1、在首次使用研究药物前4周内接受过化疗、放疗、生物治疗、内分泌治疗、免疫治疗等抗肿瘤治疗,除外以下几项:
●亚硝基脲或丝裂霉素C为首次使用研究药物前6周内;
●口服氟尿嘧啶类和小分子靶向药物为首次使用研究药物前2周或药物的5个半衰期内;
●有抗肿瘤适应症的中药为首次使用研究药物前2周内。
2、在首次使用研究药物前4周内接受过主要脏器外科手术(不包括穿刺活检)或出现过显著外伤。
3、在首次使用研究药物前14天内接受过全身使用的糖皮质激素(强的松>10mg/天或等价剂量的同类药物)或其他免疫抑制剂治疗;除外以下情况:使用局部、眼部、关节腔内、鼻内和吸入型糖皮质激素治疗;短期使用糖皮质激素进行预防治疗(例如预防造影剂过敏)。
4、在首次使用研究药物前7天内使用过CYP3A4强效抑制剂或者CYP3A4强效诱导剂。
5、既往抗肿瘤治疗的不良反应尚未恢复到CTCAE 5.0等级评价≤1级(研究者判断无安全风险的毒性除外,如脱发、2级外周神经毒性、经激素替代治疗稳定的甲状腺功能减退等)。
6、具有临床症状的中枢神经系统转移或脑膜转移,或有其他证据表明患者中枢神经系统转移或脑膜转移灶尚未控制,经研究者判断不适合入组。
6、有活动性感染,且目前需要系统性抗感染治疗者。
7、既往曾接受过PI3K、AKT或mTOR抑制剂治疗。
8、有活动性感染,且目前需要系统性抗感染治疗者。
9、有免疫缺陷病史,包括HIV抗体检测阳性。
10、活动性乙型肝炎(HBV-DNA>500IU/ml);丙型肝炎病毒感染。
11、目前患有间质性肺病者。
12、有严重的心脑血管疾病史,包括但不限于:
●需要临床干预的室性心律失常;
●QTc 间期>480ms;
●入组前6个月内有急性冠脉综合征、充血性心力衰竭、脑卒中或其他 3 级及以上心血管事件;
●美国纽约心脏病协会(NYHA)心功能分级≥II级或左室射血分数(LVEF)<50%;
13、无法口服吞咽药物,或存在经研究者判断严重影响胃肠道吸收的状况(如慢性腹泻、肠梗阻等)。
14、临床无法控制的第三间隙积液,经研究者判断不适合入组。
15、I 型糖尿病以及控制不佳的II型糖尿病。
16、已知有酒精或药物依赖。
17、精神障碍者或依从性差者。
18、妊娠期或哺乳期女性。
19、研究者认为受试者存在其他严重的系统性疾病史,或存在其他原因而不适合参加本临床研究。