欢迎访问39肿瘤网!
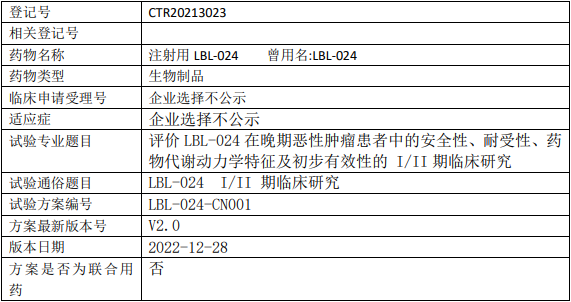
维立志博LBL-024临床试验,评价LBL-024治疗晚期恶性肿瘤安全性、耐受性、药物代谢动力学特征及初步有效性的I/II期临床试验
试验目的
Ⅰ期研究阶段主要目的
1)评价LBL-024在晚期恶性肿瘤患者中的安全性及耐受性,为后续临床研究提供指导剂量。
Ⅰ期研究阶段次要目的
1)评价LBL-024在晚期恶性肿瘤患者中的药物代谢动力学(PK)特征;
2)评价LBL-024在晚期恶性肿瘤患者中的免疫原性;
3)评价LBL-024在晚期恶性肿瘤患者中的初步有效性[基于实体瘤疗效评价标准1.1版(RECIST1.1)]。
Ⅱ期研究阶段主要目的
1)基于研究者根据RECIST1.1评估的客观缓解率(ORR)初步评估LBL-024的疗效(不包括队列A1第二阶段);
2)基于独立影像评估委员会(IRC)根据RECIST1.1评估的ORR评价LBL-024的疗效(仅限队列A1第二阶段)。
Ⅱ期研究阶段次要目的
1)基于研究者或IRC评估的其他疗效指标评估LBL-024的疗效;
2)评价LBL-024在晚期恶性肿瘤患者中的PK特征;
3)评价LBL-024在晚期恶性肿瘤患者中的免疫原性;
4)评价LBL-024在晚期恶性肿瘤患者中的安全性。
试验设计
试验分类:安全性和有效性
试验分期:其它其他说明:Ⅰ/Ⅱ期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、同意遵循试验治疗方案和访视计划,自愿入组,并书面签署知情同意书;
2、年龄18-75周岁(含边界值),性别不限
3、经组织学和/或细胞学确诊的复发或转移性晚期恶性肿瘤患者
4、东部肿瘤协作组体力状况评分标准(ECOG)为0~1分
5、预期生存时间至少12周
6、具有生育能力的男性和育龄期女性愿意从签署知情同意书开始至试验药物末次给药后6个月内采取高效避孕措施(包括禁欲、宫内节育器、各类激素避孕、正确使用避孕套等);育龄期女性包括绝经前女性和绝经后2年内的女性。育龄期女性在首次试验药物给药前7天内的血妊娠检测结果必须为阴性
排除标准
1、在首次使用研究药物前4周内接受过化疗、放疗、生物治疗、内分泌治疗、免疫治疗等抗肿瘤治疗,除外以下几项:
●亚硝基脲或丝裂霉素C为首次使用研究药物前6周内;
●口服氟尿嘧啶类和小分子靶向药物为首次使用研究药物前2周或药物的5个半衰期内(以时间长的为准);
●有抗肿瘤适应症的中成药或中草药为首次使用研究药物前2周内
2、在首次使用研究药物前4周内接受过其它未上市的临床研究药物或治疗
3、在首次使用研究药物前4周内接受过主要脏器外科手术(不包括穿刺活检)或出现过显著外伤,或需要在试验期间接受择期手术;
4、既往对抗体类药物治疗有严重的超敏反应或已知对LBL-024处方中任何组分过敏
5、具有临床症状的脑实质转移或脑膜转移,经研究者判断不适合入组;
6、有活动性感染,且目前需要静脉抗感染治疗者
7、有免疫缺陷病史,包括HIV抗体检测阳性
8、妊娠期或哺乳期女性
9、研究者认为受试者存在其他可能影响依从性或不适合参加本研究的情况