欢迎访问39肿瘤网!
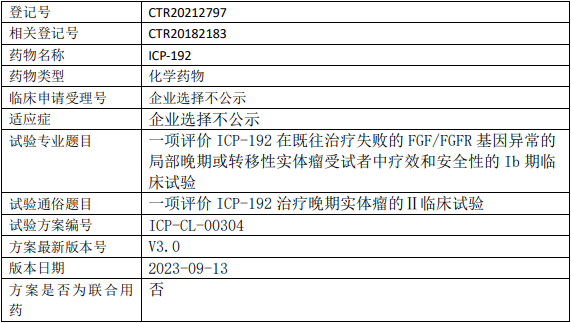
天诚医药ICP-192临床试验,评价ICP-192片治疗既往治疗失败的FGF/FGFR基因异常的局部晚期或转移性实体瘤疗效和安全性的Ib期临床试验
试验目的
评价ICP-192片在既往治疗失败的FGF/FGFR基因异常的局部晚期或转移性实体瘤受试者中的疗效(客观缓解率,Objectiveresponserate,ORR)。
试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、自愿入组并签署知情同意书。
2、年龄≥18岁,性别不限。
3、美国东部肿瘤协作组体力状态评分≤1分。
4、经细胞病理学或组织病理学证实的头颈癌或其他实体瘤,不能进行手术或放疗,且标准治疗失败或不能耐受标准治疗。
5、FGF/FGFR基因异常且符合试验方案要求。
6、根据RECISTV1.1标准,筛选期至少有一个可测量病灶作为靶病灶。
7、器官功能水平必须符合试验方案要求。
8、预期生存期至少为3个月。
9、避孕。
排除标准
1、存在需要治疗的其他恶性肿瘤。
2、既往在方案规定的时间内接受过抗肿瘤治疗。
3、已知有症状的中枢神经系统转移。
4、既往抗肿瘤治疗的毒性尚未恢复。
5、目前患有无法控制的心脑血管疾病或有既往病史。
6、根据研究者判断,有任何不稳定或不能控制的系统性疾病。
7、目前有活动性出血。
8、有活动性感染的伤口。
9、在研究药物首次给药前4周内进行了大型外科手术,或研究药物首次给药前2周内进行了小型外科手术。
10、可能增加眼部毒性风险的任何角膜或视网膜异常。
11、目前或曾患有间质性肺病者。
12、既往或当前患有影响钙-磷稳态调节的内分泌改变。
13、既往有广泛组织钙化史和/或当前存在广泛组织钙化证据。
14、临床上严重的胃肠道功能异常。
15、活动期HBV感染、活动期HCV感染、HIV感染。
16、女性受试者处于妊娠期或哺乳期。
17、正在使用或计划在参与研究期间合并服用具有细胞色素P450CYP3A强效抑制剂或诱导剂。
18、已知对研究药物辅料过敏。
19、研究者认为其他不适合参加本研究的情况。