欢迎访问39肿瘤网!
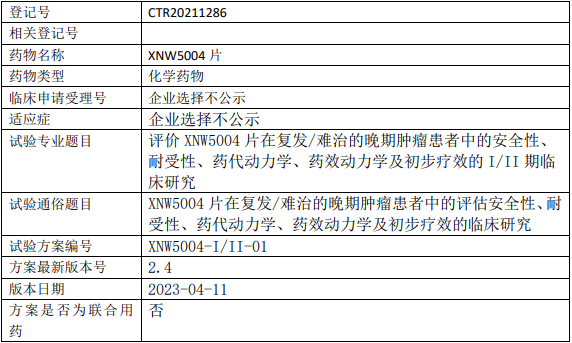
信诺维医药XNW5004临床试验,评价XNW5004片治疗复发/难治的晚期肿瘤安全性、耐受性、药代动力学、药效动力学及初步疗效的I/II期临床试验
试验目的
主要目的
评价XNW5004片在复发/难治的晚期肿瘤患者中的安全性和耐受性,支持临床II期推荐剂量(RP2D)的选择。
次要目的
1、评价XNW5004及其代谢产物XNW5004-M34在复发/难治的晚期肿瘤患者中的药代动力学(PK)特征;
2、评价XNW5004片在复发/难治的晚期肿瘤患者中的药效动力学(PD)特征;
3、评价XNW5004片治疗复发/难治的晚期肿瘤患者的初步疗效;
4、评价包括不限于EZH2突变等潜在生物标志物与疗效的相关性。
试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、晚期实体瘤和淋巴瘤:年龄:≥18岁;性别不限;
2、晚期实体瘤:组织学或细胞学确诊的、标准治疗方案无效、或不耐受标准治疗、或无标准有效治疗方案的晚期/转移性实体瘤患者;淋巴瘤:病理学确诊的、复发或难治性非霍奇金淋巴瘤(NHL)。
3、晚期实体瘤和淋巴瘤:至少有一个可测量的病灶以作为评估依据。
4、晚期实体瘤和淋巴瘤:同意提供满足检测要求的肿瘤组织样本。
5、晚期实体瘤和淋巴瘤:预期生存寿命至少12周;
6、晚期实体瘤和淋巴瘤:ECOG体力评分为0-1分;
7、晚期实体瘤和淋巴瘤:重要器官功能储备符合要求
8、晚期实体瘤和淋巴瘤:
●非手术绝育或育龄期女性患者,以及伴侣为育龄期女性的男性受试者,需要在筛选期至研究治疗期结束后6个月内采用一种经医学认可的避孕措施(如宫内节育器,避孕药或避孕套);
●非手术绝育的育龄期女性患者在研究入组前的7天内血清HCG检查必须为阴性,而且必须为非哺乳期;
9、晚期实体瘤和淋巴瘤:进行研究专用流程之前出具带有签字并标注日期的书面知情同意书,并能够遵守临床访视和研究相关的程序。
10、淋巴瘤:仅限剂量扩展阶段,病理学确诊的、复发或难治性滤泡性淋巴瘤、外周T细胞淋巴瘤和弥漫性大B细胞淋巴瘤,复发、难治定义同入选标准2:
●队列1:滤泡性淋巴瘤(EZH2突变型):基因检测结果显示存在EZH2基因突变的受试者;若受试者无法提供既往基因检测结果或既往基因检测结果无EZH2基因突变信息,则需提供肿瘤组织样本或骨髓样本(仅限存在骨髓侵犯的受试者)及血液样本,经中心实验室确认存在EZH2基因突变,方可入组本队列;
●队列2:滤泡性淋巴瘤(EZH2野生型):基因检测结果显示无EZH2基因突变的受试者;若受试者无法提供既往基因检测结果或既往基因检测结果无EZH2基因突变信息,则需提供肿瘤组织样本或骨髓样本(仅限存在骨髓侵犯的受试者)及血液样本,经中心实验室确认无EZH2基因突变,方可入组本队列;
●队列3:外周T细胞淋巴瘤,根据2016年WHO淋巴组织肿瘤分类,包括但不限于外周T细胞淋巴瘤非特指型(PTCL-NOS)、血管免疫母细胞性T细胞淋巴瘤(AITL)、ALK阳性间变大T细胞淋巴瘤及ALK阴性间变大T细胞淋巴瘤等。尽可能提供肿瘤组织样本或骨髓样本(仅限存在骨髓侵犯的受试者)及血液样本,由中心实验室进行EZH2等基因检测;
●队列4:弥漫性大B细胞淋巴瘤:入组前必须通过免疫组化及HANS模型明确GCB亚型和non-GCB亚型。尽可能提供肿瘤组织样本或骨髓样本(仅限存在骨髓侵犯的受试者)及血液样本,由中心实验室进行EZH2等基因检测;
11、淋巴瘤:在剂量递增阶段,受试者尽可能提供肿瘤组织样本或骨髓样本(仅限存在骨髓侵犯的受试者)及口腔拭子(对照样本)。若无法提供肿瘤组织样本或骨髓样本,在符合其他入排标准情况下,经研究者评估后可以入组;
排除标准
1、晚期实体瘤和淋巴瘤:既往接受与试验药物类似或相关通路的药物(如EZH1/2或EZH2抑制剂等)治疗的患者
2、晚期实体瘤和淋巴瘤:前期接受过抗肿瘤治疗而毒性仍未恢复者(根据NCI-CTCAE5.0毒性没有恢复到≤1级)。研究者认为不影响受试者安全性评价的其他毒性(如脱发等)除外
3、晚期实体瘤和淋巴瘤:在入组前5年内有其他恶性肿瘤史,且不符合临床治愈标准。
4、晚期实体瘤和淋巴瘤:心功能受损或临床上严重心脏疾病
5、晚期实体瘤和淋巴瘤:全身活动性严重感染;
6、晚期实体瘤和淋巴瘤:HIV阳性、梅毒(Anti-TB)阳性者
7、晚期实体瘤和淋巴瘤:HBsAg阳性且HBV-DNA拷贝数高于检测值正常上限;或HBsAg阳性;或HBsAg阴性,但HBcAb阳性且HBV-DNA拷贝数高于检测值正常上限;HCV抗体阳性,且HCV-RNA拷贝数高于检测值正常上限;
8、晚期实体瘤和淋巴瘤:已知对研究药物或其活性成分、辅料过敏的受试者
9、晚期实体瘤和淋巴瘤:研究治疗开始前4周内进行过大手术或在本研究期间拟行大手术的患者(穿刺或淋巴结活检等手术除外);
10、晚期实体瘤和淋巴瘤:受试者无法吞咽,或处于活跃状态的胃肠道炎症、慢性腹泻、已知的憩室病或曾接受胃切除术或胃束带等影响药物吸收的病史。但曾接受质子泵抑制剂治疗的胃食管反流是允许的(如果没有药物相互作用的可能性);
11、晚期实体瘤和淋巴瘤:首次给药前14天内,服用已知CYP3A4抑制剂/诱导剂的受试者
12、晚期实体瘤和淋巴瘤:曾患有T细胞淋巴母细胞淋巴瘤(T-LBL)或T细胞淋巴母细胞性白血病(T-ALL)的病史
13、晚期实体瘤和淋巴瘤:有任何髓系恶性肿瘤病史,包括骨髓增生异常综合症(MDS),或有与MDS或骨髓增生性肿瘤(MPN)相关检测指标异常者;
14、晚期实体瘤和淋巴瘤:有精神类药物滥用或吸毒史者;
15、晚期实体瘤和淋巴瘤:已知受试者患有出血倾向的疾病如冯维勒布兰德氏病或者血友病等或长期需要华法林或其他维生素K拮抗剂(如苯丙香豆素)治疗;
16、晚期实体瘤和淋巴瘤:可能因为其他原因而不能完成本研究或研究者认为不应纳入者。
17、晚期实体瘤:有活动性中枢神经系统转移症状。但稳定的脑实质转移或稳定的硬脊膜外脊髓压迫病史患者可以入组
18、晚期实体瘤:本试验给药前28天内参加过任何其他临床试验者,已上市药物的临床试验除外;
19、晚期实体瘤:在首次给药前4周内或5个半衰期内(以时间更短的为准)使用过化疗、生物治疗、免疫治疗、根治性放疗、大手术、靶向治疗(包括小分子酪氨酸激酶抑制剂)等抗肿瘤治疗;丝裂霉素和亚硝基脲类为首次给药前6周内;氟尿嘧啶类的口服药物如替吉奥、卡培他滨,或姑息性放疗为首次给药前2周内。
20、难治或复发的成熟淋巴瘤:既往患有或伴有中枢神经系统病变,包括但不限于:癫痫、瘫痪、脑卒中、严重脑损伤、老年痴呆、帕金森氏病、小脑疾病、脑器质性综合征、精神病等;
21、难治或复发的成熟淋巴瘤:存在中枢神经系统或睾丸侵犯的;
22、难治或复发的成熟淋巴瘤:既往接受器官移植或异体造血干细胞移植术
23、难治或复发的成熟淋巴瘤:本试验给药前3个月内进行过自体造血干细胞移植术
24、难治或复发的成熟淋巴瘤:正在使用免疫抑制剂
25、难治或复发的成熟淋巴瘤:在本试验给药前4周内接受过放疗;
26、难治或复发的成熟淋巴瘤:在本试验给药前4周内接受过化疗、靶向治疗和抗肿瘤中药等抗肿瘤治疗
27、难治或复发的成熟淋巴瘤:在本试验给药前4周内接受过免疫治疗;
28、难治或复发的成熟淋巴瘤:在本试验给药前12周内接受过CAR-T治疗;
29、难治或复发的成熟淋巴瘤:在本试验给药前4周内参加使用过任何其他临床试验药物者。
30、难治或复发的成熟淋巴瘤:仅剂量扩展阶段:滤泡性淋巴瘤3b级、混合组织学或滤泡性淋巴瘤组织学上转化为弥漫性大B细胞淋巴瘤;
31、难治或复发的成熟淋巴瘤:仅剂量扩展阶段:经FISH检测方法确诊的弥漫性大B细胞淋巴瘤伴MYC、BCL-2和/或BCL-6重排;
32、难治或复发的成熟淋巴瘤:仅剂量扩展阶段:蕈样霉菌病、塞扎里(Sézary)综合征及原发性皮肤间变大T细胞淋巴瘤;
33、难治或复发的成熟淋巴瘤:伯基特淋巴瘤,介于弥漫性大B细胞淋巴瘤与伯基特淋巴瘤之间的灰区淋巴瘤,介于弥漫性大B细胞淋巴瘤与霍奇金淋巴瘤之间的灰区淋巴瘤;
34、晚期实体瘤和淋巴瘤:本试验首次给药前1个月内有新冠疫苗接种史,本试验首次给药前3个月内有其他疫苗接种史。