欢迎访问39肿瘤网!
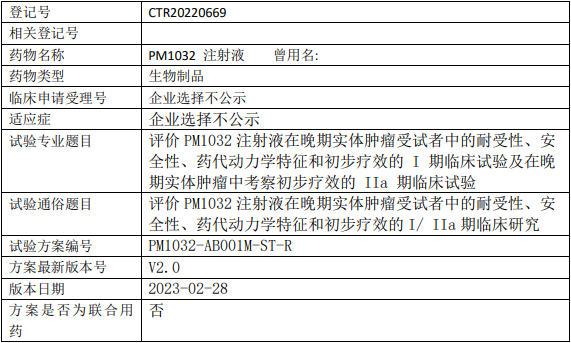
普米斯生物PM1032临床试验,评价PM1032注射液在晚期实体肿瘤受试者中的耐受性、安全性、药代动力学特征和初步疗效的I期临床试验及在晚期实体肿瘤中考察初步疗效的IIa期临床试验
试验目的
I期:评价PM1032在晚期实体肿瘤受试者治疗中的耐受性和安全性。
IIa期:初步评估PM1032在特定晚期实体肿瘤受试者治疗中的疗效。
试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、自愿参加临床试验;完全了解本试验并自愿签署知情同意书;愿意遵循并有能力完成所有试验程序;
2、男性或女性,年龄18至75岁(含边界值);
3、经组织学或细胞学证实、局部晚期不可手术切除或转移的恶性肿瘤受试者,无标准治疗方案,或标准治疗方案失败或不耐受标准治疗方案,或现阶段不适用标准治疗方案:胃/胃食管结合部腺癌、食管癌、胰腺癌、其他瘤种(胆道恶性肿瘤、结直肠癌、黏液性卵巢癌等),肿瘤组织样本经中心实验室检测CLDN18.2表达阳性(IHC:肿瘤细胞膜任意强度染色,阳性细胞比例≥1%)
4、有充足的器官功能定义如下:
4.1)血液系统(在开始研究治疗前14天内,未接受如输血、粒细胞集落刺激因子(G-CSF)或其他医学支持的情况下
4.1.1)中性粒细胞计数ANC))≥1.5×109/L
4.1.2)血小板计数PLT))≥100×109/L
4.1.3)血红蛋白Hb))≥90g/L
4.2)肝功能
4.2.1)总胆红素(TBIL)≤1.5×正常上限(ULN);Gilbert病受试者应≤3×ULN;
4.2.2)谷草转氨酶(AST)或谷丙转氨酶(ALT)水平≤2.5×ULN;肝癌或肝转移受试者≤3.0×ULN(仅适用于I期)或≤5.0×ULN(仅适用于IIa期);
4.3)肾功能:
4.3.1)血清肌酐≤1.5×ULN或肌酐清除率≥50ml/min(Cockcroft-Gault公式:([140-年龄]×体重[kg]×[0.85,仅对于女性])/(72×肌酐(mg/dL)))(肌酐单位换算:1mg/dL=88.4μmol/L);
4.3.2)尿蛋白定性≤1+;如尿蛋白定性≥2+,则需进行24h尿蛋白定量检查,如24h尿蛋白定量<1g,则可以接受;
4.4)凝血功能:国际标准化比值(INR)、活化部分凝血活酶时间(APTT)应≤1.5×ULN;肝转移或肝癌受试者应≤2×ULN;
5、体力状况美国东部肿瘤协作组(ECOG)评分为0-1;
6、预期生存期≥12周;
7、I期剂量递增研究:根据RECIST1.1,至少有一个可评估的肿瘤病灶;I期初步剂量扩展、固定剂量研究、IIa期剂量扩展研究:根据RECIST1.1,至少有一个可测量的肿瘤病灶(位于既往放疗区域或其他局部区域性治疗部位的肿瘤病灶,一般不作为可测量病灶,除非该病灶出现明确进展或放疗三个月后持续存在;不接受将仅有的骨转移或仅有的中枢神经系统转移作为可测量病灶);
8、受试者应提供研究治疗前24个月内的归档肿瘤组织标本,用于CLDN18.2分析,具体要求如下:
●受试者必须提供肿瘤组织标本,如无法获得归档标本,须在研究治疗前28天内活检采集标本(不接受骨活检标本);
●如受试者因特殊原因无法提供符合上述时限要求的标本,经申办方医学监查员同意后,受试者也可参与筛选;
●受试者须在筛选期获得CLDN18.2表达结果,阳性方可入组。
9、有生育能力的女性受试者必须在首次开始研究治疗前7天内的血清妊娠结果为阴性,且愿意从签署知情同意书起至末次用药结束后6个月内,保持禁欲或采取经医学认可的高效避孕措施(如宫内节育器、避孕套);
10、男性受试者愿意从签署知情同意书起至末次用药结束后6个月内,保持禁欲或采取经医学认可的高效避孕措施,且在此期间不捐献精子;
排除标准
1、严重过敏性疾病史、严重药物(含未上市的试验药物)过敏史或已知对本试验用药任何成分过敏;
2、既往接受过4-1BB单/双抗等免疫共刺激分子激动剂治疗;
3、既往接受过靶向CLDN18.2单/双抗或细胞治疗;
4、有肝炎(非酒精性脂肪性肝炎、酒精性或自身免疫性肝炎)或肝硬化病史;
5、活动性乙型肝炎(HBsAg或者HBcAb阳性,且HBV-DNA>500IU/mL或研究中心检测下限[仅当研究中心检测下限高于500IU/ml时]);活动性丙型肝炎(HCV抗体阳性且HCV-RNA高于研究中心检测下限),允许纳入接受除干扰素外的预防性抗病毒治疗的患者;
6、存在以下胃肠道症状:
6.1)开始研究治疗前4周内存在不可控制的呕吐;
6.2)开始研究治疗前3个月内存在需治疗的活动性消化性溃疡;
6.3)开始研究治疗前4周内存在活动性结肠炎,包括感染性、放射性、缺血性肠炎;
6.4)经研究者判断受试者存在胃出血或胃穿孔风险;
7、具有临床症状的脑实质转移或脑膜转移,经研究者判断不适合入组;
8、目前有明确的间质性肺病或非感染性肺炎,局部放疗引起的除外;
9、目前存在无法控制的胸腔、心包、腹腔积液;
10、目前存在需要静脉抗感染治疗的活动性感染者;
11、患有活动性、或曾患过且有复发可能的自身免疫性疾病的患者(如系统性红斑狼疮,类风湿性关节炎,血管炎等),除外临床稳定的自身免疫甲状腺病、I型糖尿病患者;
12、既往接受免疫治疗者,发生过≥3级的免疫治疗相关不良事件(irAE)或≥2级免疫相关性心肌炎;
13、既往抗肿瘤治疗的不良反应尚未恢复到NCI-CTCAEV5.0等级评价≤1级(研究者判断无安全风险的毒性除外,如脱发、2级外周神经毒性、经激素替代治疗稳定的甲状腺功能减退等);
14、在开始研究治疗前接受过以下治疗或药物:
14.1)开始研究治疗前28天之内接受过重要脏器外科手术(不包括穿刺活检),或需要在试验期间接受择期手术;
14.2)开始研究治疗前28天内接种过减毒活疫苗;
14.3)首次给药前4周内接受过化疗、免疫检查点激动剂治疗、免疫检查点抑制剂治疗(如细胞毒T淋巴细胞相关抗原-4(CTLA-4)、PD-1、PD-L1、LAG3单/双抗等)、根治性/广泛性放疗、生物治疗、内分泌治疗等抗肿瘤药物治疗,以下几项也需除外:6周内接受过亚硝基脲或丝裂霉素C治疗;2周内口服氟尿嘧啶类和小分子靶向药物或扔在药物的5个半衰期内(以时间长的为准);2周内接受过有抗肿瘤适应症的中药治疗;7天内接受过重要器官(如脑、肝、肺)姑息性放疗;
14.4)开始研究治疗前14天内接受过全身使用的糖皮质激素(强的松>10mg/天或等价剂量的同类药物)或其他免疫抑制剂治疗;以下情况除外:使用局部、眼部、关节腔内、鼻内和吸入型糖皮质激素治疗;短期使用糖皮质激素进行预防治疗(如预防造影剂过敏);
14.5)开始研究治疗前14天内使用过静脉广谱抗生素≥7天(仅适用于I期初步剂量扩展、IIa期剂量扩展、固定剂量研究);
15、开始研究治疗前3个月内存在活动性出血;
16、开始研究治疗前5年内,曾患有其他活动性恶性肿瘤,可进行局部治疗且已治愈的恶性肿瘤除外(如皮肤基底细胞或鳞状细胞癌、浅表性或非侵袭性膀胱癌、宫颈原位癌、乳腺导管内原位癌、甲状腺乳头状癌)(适用于IIa期);
17、既往曾接受过异基因造血干细胞移植或器官移植者;
18、需长期使用非甾体类抗炎药(NSAIDs);
19、有严重的心脑血管疾病史,包括但不限于:
19.1)存在严重的心脏节律或传导异常,如需要临床干预的室性心律失常、II-III度房室传导阻滞;
19.2)经Fridericia法校正的QT间期(QTcF)均值,男性>450ms,或女性>470ms;
19.3)开始研究给药前6个月内发生急性冠脉综合征、充血性心力衰竭、主动脉夹层、脑卒中或其他3级及以上心脑血管事件;
19.4)美国纽约心脏病协会(NYHA)心功能分级≥II级,或左室射血分数(LVEF)<50%;
19.5)临床无法控制的高血压(经治疗后收缩压≥160mmHg和/或舒张压≥100mmHg);
19.6)存在任何可能增加QTc延长或心律失常风险的因素,如心衰或正在使用任何已知可延长QT间期的伴随药物;
20、已知有酒精滥用、精神类药物滥用或吸毒史;
21、精神障碍者或依从性差者;
22、有免疫缺陷病史,包括HIV抗体检测阳性;
23、活动性梅毒感染;
24、经研究者判断,受试者基础病情可能会增加其接受试验用药治疗的风险,或是对于出现的毒性反应及AE的解释造成混淆的;
25、妊娠期或哺乳期女性;
26、其他研究者认为不适合参加本研究的情况。